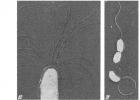
Выявление жгутиков.Рассмотреть жгутик (или пучок жгутиков) в проходящем свете или в условиях фазового контраста удается только у немногих бактерий, например у Chromatium okenii, Bdellovibrio,Thiospirillum
(рис. 2.37). У многих других бактерий (Pseudomonas, Spirillum
и др.) жгутик и зону его биения можно увидеть только в темном поле. Легче всего выявлять жгутики путем нанесения на них красителя или металла, а также с помощью электронного микроскопа.
Функции жгутиков.У большинства бактерий с полярным расположением жгутиков последние действуют подобно корабельному винту и проталкивают клетку в окружающей жидкой среде. Жгутик представляет собой спирально извитую нить, приводимую во вращательное движение «мотором», находящимся в месте ее прикрепления в плазматической мембране. Для перемещения клетки может служить одиночный жгутик или пучок жгутиков. Жгутики вращаются сравнительно быстро; например, у спирилл они совершают около 3000 оборотов в минуту, что близко к скорости среднего электромотора. Вращение жгутиков приводит к тому, что тело клетки вращается примерно с 1/3 этой скорости в противоположном направлении.
Жгутики могут спонтанно или в ответ на внешний стимул изменять направление вращения (рис. 2.34). У некоторых бактерий с полярным расположением жгутиков это приводит к тому, что клетка начинает двигаться вспять. Когда у Chromatium okenii
в ответ на вспышку света направление вращения жгутиков меняется, пучок жгутиков превращается в тянущее приспособление; при этом назад клетка перемещается в четыре раза медленнее, чем вперед, и ее движение становится «кувыркающимся». У Thiospirillum jenense -
гигантской фототрофной спириллы - единственный полярный пучок жгутиков при обратном движении бьется уже не впереди клетки: пространство биения жгутиков теперь охватывает клетку с боков: оно как бы вывернуто наизнанку (подобно вывернутому ветром зонту). У спирилл с амфитрихальным расположением жгутиков в таком положении находится, смотря по обстоятельствам, то один, то другой пучок.
Перитрихально расположенные жгутики Escherichia coli
работают как один хорошо скоординированный спиральный пучок и проталкивают клетку через среду. В тех случаях, когда направление вращения отдельных жгутиков меняется, клетка начинает «кувыркаться». По-видимому, перитрихально расположенные жгутики не могут служить тянущим приспособлением.
Бактерии, снабженные жгутиками, могут передвигаться очень быстро: Bacillus megaterium
со скоростью 1,6 мм/мин, Vibrio cholerae -
12 мм/мин. Это соответствует примерно от 300 до 3000 длин тела в минуту.
Тонкое строение жгутиков.Жгутики представляют собой спирально закрученные нити. У разных бактерий они различаются по своей толщине (12-18 нм), длине (до 20 мкм), а также по длине и амплитуде витка. Эти параметры характерны для каждого вида. У некоторых бактерий могут образовываться жгутики разных типов. Нити жгутиков состоят из специфического белка флагеллина. Они построены из субъединиц с относительно малой молекулярной массой. Субьединицы располагаются по спирали вокруг внутреннего свободного пространства (подобно белковым молекулам в вирусе табачной мозаики). Таким образом, структура жгутика определяется свойствами белковых субъединиц.
Жгутик состоит из трех частей - описанной выше спиральной нити, «крюка» вблизи поверхности клетки и базального тельца. С помощью базального тельца жгутик закреплен в плазматической мембране и в клеточной стенке (рис. 2.38). Оно состоит из центрального стержня, на котором у грам-отрицательных бактерий находятся две пары колец. Наружная пара (кольца L и Р) расположены на уровне наружного и внутреннего слоев клеточной стенки, а внутренняя пара (кольца S и М) - на уровне наружного слоя плазматической мембраны. Так как у грам-положительных бактерий наружная пара колец отсутствует, полагают, что для вращения жгутиков необходима только внутренняя пара. Можно представить себе, что кольцо М действует как приводной диск, а кольцо S играет роль подшипника на внутренней поверхности пептидогликанового слоя. Молекулярный механизм вращательного «мотора» жгутика пока не выяснен.
Выявление жгутиков.Рассмотреть жгутик (или пучок жгутиков) в проходящем свете или в условиях фазового контраста удается только у немногих бактерий, например у Chromatium okenii, Bdellovibrio,Thiospirillum
(рис. 2.37). У многих других бактерий (Pseudomonas, Spirillum
и др.) жгутик и зону его биения можно увидеть только в темном поле. Легче всего выявлять жгутики путем нанесения на них красителя или металла, а также с помощью электронного микроскопа.
Функции жгутиков.У большинства бактерий с полярным расположением жгутиков последние действуют подобно корабельному винту и проталкивают клетку в окружающей жидкой среде. Жгутик представляет собой спирально извитую нить, приводимую во вращательное движение «мотором», находящимся в месте ее прикрепления в плазматической мембране. Для перемещения клетки может служить одиночный жгутик или пучок жгутиков. Жгутики вращаются сравнительно быстро; например, у спирилл они совершают около 3000 оборотов в минуту, что близко к скорости среднего электромотора. Вращение жгутиков приводит к тому, что тело клетки вращается примерно с 1/3 этой скорости в противоположном направлении.
Жгутики могут спонтанно или в ответ на внешний стимул изменять направление вращения (рис. 2.34). У некоторых бактерий с полярным расположением жгутиков это приводит к тому, что клетка начинает двигаться вспять. Когда у Chromatium okenii
в ответ на вспышку света направление вращения жгутиков меняется, пучок жгутиков превращается в тянущее приспособление; при этом назад клетка перемещается в четыре раза медленнее, чем вперед, и ее движение становится «кувыркающимся». У Thiospirillum jenense -
гигантской фототрофной спириллы - единственный полярный пучок жгутиков при обратном движении бьется уже не впереди клетки: пространство биения жгутиков теперь охватывает клетку с боков: оно как бы вывернуто наизнанку (подобно вывернутому ветром зонту). У спирилл с амфитрихальным расположением жгутиков в таком положении находится, смотря по обстоятельствам, то один, то другой пучок.
Перитрихально расположенные жгутики Escherichia coli
работают как один хорошо скоординированный спиральный пучок и проталкивают клетку через среду. В тех случаях, когда направление вращения отдельных жгутиков меняется, клетка начинает «кувыркаться». По-видимому, перитрихально расположенные жгутики не могут служить тянущим приспособлением.
Бактерии, снабженные жгутиками, могут передвигаться очень быстро: Bacillus megaterium
со скоростью 1,6 мм/мин, Vibrio cholerae -
12 мм/мин. Это соответствует примерно от 300 до 3000 длин тела в минуту.
Тонкое строение жгутиков.Жгутики представляют собой спирально закрученные нити. У разных бактерий они различаются по своей толщине (12-18 нм), длине (до 20 мкм), а также по длине и амплитуде витка. Эти параметры характерны для каждого вида. У некоторых бактерий могут образовываться жгутики разных типов. Нити жгутиков состоят из специфического белка флагеллина. Они построены из субъединиц с относительно малой молекулярной массой. Субьединицы располагаются по спирали вокруг внутреннего свободного пространства (подобно белковым молекулам в вирусе табачной мозаики). Таким образом, структура жгутика определяется свойствами белковых субъединиц.
Жгутик состоит из трех частей - описанной выше спиральной нити, «крюка» вблизи поверхности клетки и базального тельца. С помощью базального тельца жгутик закреплен в плазматической мембране и в клеточной стенке (рис. 2.38). Оно состоит из центрального стержня, на котором у грам-отрицательных бактерий находятся две пары колец. Наружная пара (кольца L и Р) расположены на уровне наружного и внутреннего слоев клеточной стенки, а внутренняя пара (кольца S и М) - на уровне наружного слоя плазматической мембраны. Так как у грам-положительных бактерий наружная пара колец отсутствует, полагают, что для вращения жгутиков необходима только внутренняя пара. Можно представить себе, что кольцо М действует как приводной диск, а кольцо S играет роль подшипника на внутренней поверхности пептидогликанового слоя. Молекулярный механизм вращательного «мотора» жгутика пока не выяснен.
 О- и Н-аитигены.Proteus vulgaris
часто распространяется по всей поверхности агара в виде тонкого серого налета (Н-форма, от нем. Hauch - налет). Такое «роение» объясняется большой подвижностью клеток. Некоторые штаммы налета не образуют (О-форма, от нем. ohne Hauch - без налета). Эти штаммы неподвижны, они лишены жгутиков. Отсюда ведет свое начало обычная терминология, принятая в бактериальной серодиагностике; антигены поверхности или вообще тела клетки (соматические) называют О-антигенами, а антигены жгутиков - Н-антигенами.
Фимбрии и пили.Поверхность некоторых бактерий покрыта большим числом (от 10 до нескольких тысяч) длинных, тонких прямых нитей толщиной 3-25 нм и длиной до 12 мкм, называемых фимбриями или пилями. Они встречаются как у жгутиконосных видов, так и у форм, лишенных жгутиков. От них следует отличать половые пили, или пили типа F, которые были обнаружены у клеток - доноров Escherichia coli
К 12, т.е. у штаммов, содержащих половой фактор F (F + , Hfr). Пили F встречаются только по одной или по две на клетку, они имеют вид полых белковых трубочек длиной от 0,5 до 10 мкм.
Хемотаксис.Свободно передвигающиеся бактерии способны к таксисам - направленным движениям, определяемым внешними стимулами. В зависимости от факторов среды, вызывающих направленное движение, говорят о хемотаксисе, аэротаксисе, фототаксисе и магнитотаксисе.
Подвижные бактерии реагируют на химические раздражители - скапливаются в одних местах, а других мест избегают. Такая реакция свободно передвигающихся организмов называется хемотаксисом. Скопления бактерий образуются под действием химических факторов следующим образом (рис. 2.39). У форм с перитрихальными жгутиками возможны только два типа двигательного поведения: прямолинейное движение и кувыркание. Последнее прерывает прямолинейную пробежку и изменяет направление пути. Когда бактерия оказывается в среде с градиентом концентрации «привлекающего» ее субстрата (аттрактанта), ее прямолинейное движение длится многие секунды, если она плывет по направлению к оптимальной его концентрации; однако такое движение через несколько секунд прекратится, если бактерия плывет в противоположном направлении. Хотя направление прямолинейного движения после кувыркания оказывается совершенно случайным, тем не менее зависимость длительности такого движения от его направления приводит в конечном результате к накоплению бактерий в области оптимальной концентрации субстрата. За чувствительность к химическому стимулу и за реагирование на него ответственны хеморецепторы. В ряде случаев эти хеморецепторы действуют независимо от способности бактерий утилизировать данный субстрат. Например, некоторые мутанты продолжают совершенно нормально реагировать на определенное питательное вещество, хотя и потеряли способность его использовать.
О- и Н-аитигены.Proteus vulgaris
часто распространяется по всей поверхности агара в виде тонкого серого налета (Н-форма, от нем. Hauch - налет). Такое «роение» объясняется большой подвижностью клеток. Некоторые штаммы налета не образуют (О-форма, от нем. ohne Hauch - без налета). Эти штаммы неподвижны, они лишены жгутиков. Отсюда ведет свое начало обычная терминология, принятая в бактериальной серодиагностике; антигены поверхности или вообще тела клетки (соматические) называют О-антигенами, а антигены жгутиков - Н-антигенами.
Фимбрии и пили.Поверхность некоторых бактерий покрыта большим числом (от 10 до нескольких тысяч) длинных, тонких прямых нитей толщиной 3-25 нм и длиной до 12 мкм, называемых фимбриями или пилями. Они встречаются как у жгутиконосных видов, так и у форм, лишенных жгутиков. От них следует отличать половые пили, или пили типа F, которые были обнаружены у клеток - доноров Escherichia coli
К 12, т.е. у штаммов, содержащих половой фактор F (F + , Hfr). Пили F встречаются только по одной или по две на клетку, они имеют вид полых белковых трубочек длиной от 0,5 до 10 мкм.
Хемотаксис.Свободно передвигающиеся бактерии способны к таксисам - направленным движениям, определяемым внешними стимулами. В зависимости от факторов среды, вызывающих направленное движение, говорят о хемотаксисе, аэротаксисе, фототаксисе и магнитотаксисе.
Подвижные бактерии реагируют на химические раздражители - скапливаются в одних местах, а других мест избегают. Такая реакция свободно передвигающихся организмов называется хемотаксисом. Скопления бактерий образуются под действием химических факторов следующим образом (рис. 2.39). У форм с перитрихальными жгутиками возможны только два типа двигательного поведения: прямолинейное движение и кувыркание. Последнее прерывает прямолинейную пробежку и изменяет направление пути. Когда бактерия оказывается в среде с градиентом концентрации «привлекающего» ее субстрата (аттрактанта), ее прямолинейное движение длится многие секунды, если она плывет по направлению к оптимальной его концентрации; однако такое движение через несколько секунд прекратится, если бактерия плывет в противоположном направлении. Хотя направление прямолинейного движения после кувыркания оказывается совершенно случайным, тем не менее зависимость длительности такого движения от его направления приводит в конечном результате к накоплению бактерий в области оптимальной концентрации субстрата. За чувствительность к химическому стимулу и за реагирование на него ответственны хеморецепторы. В ряде случаев эти хеморецепторы действуют независимо от способности бактерий утилизировать данный субстрат. Например, некоторые мутанты продолжают совершенно нормально реагировать на определенное питательное вещество, хотя и потеряли способность его использовать.
 Аэротаксис.У подвижных бактерий можно определить тип метаболизма (аэробный или анаэробный) по их аэротаксическим движениям и скоплению на определенных расстояниях от края покровного стекла. В слое бактерий, помещенных между предметным и покровным стеклами, аэрофильные бактерии скапливаются у края покровного стекла или в непосредственной близости от оказавшихся в препарате пузырьков воздуха; это указывает на их потребность в аэробных условиях и на то, что необходимую энергию они получают за счет дыхания (рис. 2.40). Строго анаэробные бактерии будут скапливаться в центре. Микроаэрофильные бактерии, например некоторые псевдомонады и спириллы, будут держаться на определенном расстоянии от края. С помощью бактерий, проявляющих положительный аэротаксис, Энгельману удалось продемонстрировать выделение кислорода локально освещаемыми хлоропластами зеленой водоросли Spirogyra.
Аэротаксис.У подвижных бактерий можно определить тип метаболизма (аэробный или анаэробный) по их аэротаксическим движениям и скоплению на определенных расстояниях от края покровного стекла. В слое бактерий, помещенных между предметным и покровным стеклами, аэрофильные бактерии скапливаются у края покровного стекла или в непосредственной близости от оказавшихся в препарате пузырьков воздуха; это указывает на их потребность в аэробных условиях и на то, что необходимую энергию они получают за счет дыхания (рис. 2.40). Строго анаэробные бактерии будут скапливаться в центре. Микроаэрофильные бактерии, например некоторые псевдомонады и спириллы, будут держаться на определенном расстоянии от края. С помощью бактерий, проявляющих положительный аэротаксис, Энгельману удалось продемонстрировать выделение кислорода локально освещаемыми хлоропластами зеленой водоросли Spirogyra.
 Фототаксис. Фототрофным пурпурным бактериям для получения энергии необходим свет. Не удивительно поэтому, что в результате фототаксиса они скапливаются в освещенном месте. Если выдержать в темноте препарат, в котором плотная суспензия клеток Chromatium будет равномерно распределена под покровным стеклом, а затем направить на него сфокусированный пучок света, то бактерии сосредоточатся в области светового пятна. Клетки, попавшие в это пятно случайно в результате своего беспорядочного движения, уже не могут его покинуть. Как только они попадут в темную зону, направление движения жгутиков мгновенно меняется на обратное и клетки возвращаются в освещенное место. Изменение работы жгутиков происходит так быстро, что эта реакция получила название «реакция испуга» (фоботаксис). Впрочем, для того чтобы вызвать такой ответ, достаточно даже небольшого различия в освещенности двух участков. Мелкие клетки Chromatium скапливаются уже в таком месте, где освещенность всего на 0,7% выше, чем в окружающей области. Таким образом, по своей чувствительности к световому контрасту они приближаются к сетчатке человеческого глаза (для которой соответствующий порог равен 0,4%).
Магиитотаксис. Из поверхностных слоев донного ила пресноводных водоемов, а также морей были выделены бактерии (палочки, спириллы, кокки), способные ориентироваться в магнитном поле и перемещаться в направлении линий магнитного поля. Они содержат много железа (0,4% сухого вещества) в форме ферромагнитной окиси железа (магнетита), которая находится в гранулах (магнитосомах), расположенных около мест прикрепления жгутиков. Бактерии, выделенные в северном полушарии, «ищут» север; здесь линии магнитного поля проходят под углом около 70° к горизонту вниз, вглубь водоема. Магнитотаксическоё поведение направляет бактерии в глубину ила, где очень мало или вовсе нет кислорода. Так как магнитотаксические бактерии - анаэробы или микроаэрофилы, их реакция на магнитное поле понятна с точки зрения экологии. Такие клетки, завезенные в южное полушарие, в массе своей, конечно, погибнут; выживут лишь немногие «неправильно» поляризованные клетки, которые могут затем размножиться. Полярность, очевидно, генетически не зафиксирована.
Фототаксис. Фототрофным пурпурным бактериям для получения энергии необходим свет. Не удивительно поэтому, что в результате фототаксиса они скапливаются в освещенном месте. Если выдержать в темноте препарат, в котором плотная суспензия клеток Chromatium будет равномерно распределена под покровным стеклом, а затем направить на него сфокусированный пучок света, то бактерии сосредоточатся в области светового пятна. Клетки, попавшие в это пятно случайно в результате своего беспорядочного движения, уже не могут его покинуть. Как только они попадут в темную зону, направление движения жгутиков мгновенно меняется на обратное и клетки возвращаются в освещенное место. Изменение работы жгутиков происходит так быстро, что эта реакция получила название «реакция испуга» (фоботаксис). Впрочем, для того чтобы вызвать такой ответ, достаточно даже небольшого различия в освещенности двух участков. Мелкие клетки Chromatium скапливаются уже в таком месте, где освещенность всего на 0,7% выше, чем в окружающей области. Таким образом, по своей чувствительности к световому контрасту они приближаются к сетчатке человеческого глаза (для которой соответствующий порог равен 0,4%).
Магиитотаксис. Из поверхностных слоев донного ила пресноводных водоемов, а также морей были выделены бактерии (палочки, спириллы, кокки), способные ориентироваться в магнитном поле и перемещаться в направлении линий магнитного поля. Они содержат много железа (0,4% сухого вещества) в форме ферромагнитной окиси железа (магнетита), которая находится в гранулах (магнитосомах), расположенных около мест прикрепления жгутиков. Бактерии, выделенные в северном полушарии, «ищут» север; здесь линии магнитного поля проходят под углом около 70° к горизонту вниз, вглубь водоема. Магнитотаксическоё поведение направляет бактерии в глубину ила, где очень мало или вовсе нет кислорода. Так как магнитотаксические бактерии - анаэробы или микроаэрофилы, их реакция на магнитное поле понятна с точки зрения экологии. Такие клетки, завезенные в южное полушарие, в массе своей, конечно, погибнут; выживут лишь немногие «неправильно» поляризованные клетки, которые могут затем размножиться. Полярность, очевидно, генетически не зафиксирована.
Для изучения микробов необходимы соответствующие лабораторная обстановка и оборудование. Помещение для лабораторий подбирают просторное, светлое, чистое и изолированное. Работа в лаборатории требует особой осторожности, так как приходится работать с заразным материалом. Микроскопирование. Вследствие очень малых размеров микроорганизмы изучают с помощью специальной аппаратуры - микроскопов.
Микроскоп состоит из двух частей: механической и оптической. Механическая часть микроскопа состоит из штатива, тубyca 7 (рис. 6), «револьвера» 2, предметного столика 4, микрометрического 10 и макрометрического 11 винтов. К оптической части относятся объективы 3, окуляры, зеркала 6, осветительный аппарат 5 (конденсор). Оптическая часть - наиболее важная часть микроскопа. Под предметным стеклом находятся зеркало и конденсоры. Зеркало служит для отражения (???) направления световых лучей через конденсор в объектив. Конденсор состоит из нескольких линз, которые собирают отраженные от зеркала лучи на уровне исследуемого предмета. На нижней поверхности осветительного прибора укреплена ирис-диафрагма, с помощью которой можно уменьшать или увеличивать освещение изучаемого предмета. Объектив состоит из нескольких линз, заключенных в общую металлическую оправу, на которую наносится цифра, указывающая увеличение. Окуляр состоит из двух линз и дает увеличение изображения, которое получается (???) от объектива. На окуляре также имеется цифра, указывающая увеличение. Общее увеличение микроскопа равно произведению увеличения объектива на увеличение окуляра.
Разрешающая способность микроскопа ограничивается длиной световой волны.
Имеются микроскопы более усовершенствованных конструкций. Так, в бинокулярных микроскопах предметы рассматриваются обоими глазами, благодаря чему получается более рельефное изображение объектов. Сконструированы ультрамикроскопы, предназначенные для рассматривания объектов, имеющих размеры менее 0,2 мк. Предметы в этих микроскопах освещают не проходящими лучами, как в обычном микроскопе, а боковыми, исходящими от сильного источника света.
Электронный микроскоп, дающий увеличение от 20 000 до 200 000 раз и более, был изобретен в 1932 году. При его помощи можно изучать такие микроорганизмы, как вирусы, имеющие размеры в несколько миллимикрон. В этих микроскопах через изучаемый предмет пропускается поток быстролетящих электронов, причем изображение получается на специальном экране.
В последние годы, кроме описанных выше, стали внедряться практику также люминесцентные фазово-контрастные микроскопы, применение которых расширило возможности изучения микроорганизмов. Так, при люминесцентной микроскопии изучаемый предмет освещается ультрафиолетовыми лучами от специального источника. При этом некоторые микробы, поглощающие энергию, могут затем давать видимое цветное (зеленое, желтое, фиолетовое) излучение. Таким образом, в отличие от обычной микроскопии в люминесцентном микроскопе рассматривают объекты в излучаемом ими свете.
В фазово-контрастном микроскопе более четко изучается внутренняя структура живых клеток в процессе жизнедеятельности и функция движений. Это достигается с помощью специально устроенных фазовых (кольцевых) объективов и конденсора. Они изменяют фазу волны проходящего света, резко повышая контрастность изображения.
Рис. 6. Микроскоп:
1 - тубус; 2 - «револьвер»; 3 - объектив; 4 - предметный столик; 5 - осветительный аппарат; 6 - зеркало; 7 - ножка; 8 - шарнир; 9 - колонка; 10 - микрометрический винт; // - макрометрический винт; 12 - окуляр.
Питательные среды. Для исследования разнообразных свойств микробов их выращивают на питательных средах. Чтобы микробы могли размножаться, такая среда должна содержать достаточное количество питательных веществ, воду, минеральные соли и источники азота и углерода. Особое внимание обращают на то, чтобы среда для выращивания микробов была стерильной, так как загрязнение питательной среды делает ее непригодной для использования.
Различают естественные и искусственные питательные среды. В качестве естественных питательных сред применяют молоко, желчь, картофель, морковь, яйца и др. .Искусственные питательные среды готовят в основном из мясных или растительных настоев, добавляя в них различные азотистые продукты, углеводы и соли.
Подопытные животные. Роль отдельных микробов в возникновении заболеваний, изучение характера инфекционного процесса, метода лечения и профилактики многих инфекционных заболеваний были выяснены благодаря широкому использованию в микробиологии метода экспериментального заражения подопытных животных.
Из лабораторных животных в микробиологической практике наиболее широко используют морских свинок, кроликов, белых мышей, белых крыс, иногда - обезьян, мелкий и крупный рогатый скот, кошек, собак и редко птиц (голубей, кур). Выбор того или другого животного для исследования зависит от двух условий: во-первых, животное должно быть восприимчиво к данной инфекции, во-вторых, в естественных условиях у него не должно быть данной инфекции. Поэтому для изучения каждой инфекции используют отдельный вид животного. Например, при изучении туберкулеза и дифтерии подопытными являются морские свинки, при изучении бешенства - кролики и др.
Получив достаточно информации о мире микроорганизмов, мне стало интересно на них посмотреть, и увидеть, на конкретных примерах, как они работают (Приложение 3
).
Для этого я решила провести ряд экспериментов. Быстрее всего дождаться результата, оказалось, от деятельности дрожжей.
Полезное применение микроорганизмов на примере дрожжей.
Замесила две порции теста: одна порция дрожжевого, другая без добавления дрожжей и испекла булочки.
через 20 минут дрожжевое тесто стало подниматься, т.е. началась работа микроорганизмов, а обычное тесто осталось без изменения. Пирожки из дрожжевого теста получилась пышными, мягкими и вкусными, а булочки из теста без добавления дрожжей получились тяжелые и плоские.
Вывод: дрожжи вырабатывают углекислый газ, в результате этого тесто «растет» поднимается, становится пышным.
Наблюдение за молоком (опыт взят из моего прошлогоднего проекта!).
Я поставила два стакана с молоком в холодильник, и два стакана оставила на сутки на батарее (по одному стакану с пастеризованным и кипяченым молоком).
пастеризованное молоко на батарее скисло на второй день, на третий день скисло кипяченое молоко на батарее, затем на седьмой день скисло пастеризованное молоко в холодильнике, на девятый день скисло кипяченое молоко в холодильнике! (Таблица 1).
Приложение 3. Таблица 1
Наблюдение за молоком
(Опыт 2)
Вывод: бактерии гниения испортили молоко, а бактерии молочнокислого брожения превратили его в простоквашу, которую можно употреблять в пищу. В холодильнике дольше хранится кипяченое молоко, а быстрее скисает пастеризованное.
Я увидела, как действуют молочные микроорганизмы.
Получение сметаны из сливок.
Взяла сливки и поставила их в теплое место.
через день получила сметану, даже не взбивая.
Вывод: сливки быстро скисают в теплом месте в открытой емкости.
Таким образом, я убедилась, что «полезные» микроорганизмы помогают сделать многие продукты вкусными и полезными!
Определение микроорганизмов при наличии консервантов в питательной среде.
Я создала питательную среду для размножения бактерий (сварила «живой бульон» и бульон из куриного кубика «Knor», добавила в него сахар). Разлила по четырем пробиркам. Пробирки пометила цветом, и пронумеровала. Первую (синюю и красную) пробирку оставила чистой, а во вторую (синюю и красную) опустила палец. Все пробирки закрыла крышкой, и поставила в теплое место (Таблица 2 ).
Таблица 2
Определение микроорганизмов
при наличии консервантов в питательной среде
(Опыт 4)
| Дата (период появления микро-организмов) | Маркированная проба с питательной средой (описание) | |||||
| 1 | 2 | 1 | 2 | |||
| Бульон «Knor» (синий) | «Живой» бульон (синий) | Бульон «Knor» (красный), палец | «Живой» бульон (красный), палец | |||
 |
 |
 |
||||
| 08.01.2017 – 10.01.2017 (2 дня) |
помутнение бульона | |||||
| 08.01.2017 – 11.01.2017 (3 дня) |
появился неприятный запах | |||||
| 08.01.2017 – 12.01.2017 (4 дня) |
появилась пена | появился незначительный осадок | появились пятна плесени | появился осадок | ||
| 08.01.2017 – 13.01.2017 (4 дня) |
- | - | пятна плесени увеличились в диаметре | |||
| 08.01.2017 – 16.01.2017 (7 дней) |
- | количество осадка увеличилось | пятна плесени продолжают расти | увеличение осадка в два раза | ||
через два дня жидкость в сосудах помутнела, через 3 дня стала издавать неприятный запах. Я обратила внимание на то, что на четвертый день во всех образцах с «живым» бульоном появился осадок, причем в образце с опущенным пальцем осадка оказалось больше.
В пробирках с бульоном из кубика изменения начали происходить на поверхностной пленке каждого из образцов, но в образце с опущенным пальцем на поверхности начала образовываться плесень.
Получается, что микроорганизмы присутствуют во всех четырех пробах, но в разном количестве (это еще раз подтверждает тот факт, что на наших руках обитают бактерии), однако в пробирках с опущенным пальцем процесс размножения микроорганизмов происходит в несколько раз быстрее.
После этого я взяла несколько капель жидкости из пробирок и попыталась рассмотреть их под микроскопом, насколько это оказалось возможным. В образцах с «живым» и «неживым» бульоном были обнаружены разные виды микроорганизмов.
Вывод: во всех образцах подтвердился факт наличия в жидкости микроорганизмов. Странным мне показался факт размножения микроорганизмов в среде с консервантом. Ведь считается, что в таких условиях микроорганизмы не должны выживать, консервант их должен убивать. Объяснить такое поведение микроорганизмов я могу лишь истечением срока годности бульонного кубика, ведь врачи не рекомендуют употреблять продукты питания после истечения срока годности!
Определение благоприятных условий для развития и размножения бактерий.
Взяла два кусочка хлеба и поместила их в плотно закрытые полиэтиленовые пакеты. Один положила в холодильник, другой – в теплое место, на подоконник, где всегда солнышко.
через три дня я заметила, что на пакете, с опытным образцом, который находился в тепле, выступили капли воды, а еще через день стали образовываться пятна плесени (Таблица 3
).
Таблица 3
Наблюдение за хлебом
(Опыт 5)
Вывод: на корочке хлеба появилась плесень – мукор . Микроорганизмы вызывают порчу продуктов! Плесень может развиваться только в теплом и влажном месте, особенно богатом питательными веществами, а сухость воздуха и низкая температура являются главными препятствиями для развития плесени.
Следовательно, с большой долей вероятности можно предположить, что и «плохие» микроорганизмы предпочитают развиваться в теплой влажной среде.
Наличие микроорганизмов на немытых и мытых руках.
В две чистые чашки положила питательную среду: вымытый клубень картофеля очистила, разрезала пополам, и вымочила 2-3 ч. в растворе соды (1 ч.л./500 мл. воды), затем сварила его и разрезала на лом-тики. Прикоснулась немытыми руками к одному пласту картофеля, а затем мытыми к другому. Закрыла чашки крышками, и поставила в темное теплое место на 4 дня.
через четыре дня на ломтике картофеля, к которому прикасалась грязными руками, вы-росли бактерии (Таблица 4
).
Таблица 4
Наличие микроорганизмов на немытых и мытых руках
(Опыт 6)
| № пробы | Наименование исследуемого объекта | 1 день (02.01.2017) | 3 день (04.01.2017) | 5 день (06.01.2017) |
| 1 | Ломтик картофеля (чистые руки) | - | при взаимодействии пигмента с щелочью (мыло) образуется оранжево-желтая окраска, поэтому на данном образце появился налет желтого цвета, а красного пигмента не обнаружено | - |
| 2 | Ломтик картофеля (грязные руки) | - | появились пятна желто-оранжевого цвета (кокки), и красный пигмент характерный для крахмалсодержащих продуктов продигиозин , который вырабатывают бактерии «чудесной крови», не патогенны, но продукты их жизнедеятельности являются токсичными | пятна плесени стали крупнее и ярче |
Вывод: микроорганизмы не любят чистоту, мыло их убивает!
Наличие микроорганизмов на предметах.
Взяла ватной палочкой пробу с перил лестничной клетки своего подъезда. Образец поместила в пробирку с питательной средой («живой» бульон), и убрала в теплое, темное место.
через один день произошло изменение цвета, что говорит о присутствии вредных бактерий, а через три дня выпал белый творожистый осадок - колонии бактерий (Таблица 5 ).
Таблица 5
Наличие микроорганизмов на предметах
(Опыт 7)
Вывод: на предметах вокруг нас очень много различных микроорганизмов, не всегда полезных, поэтому необходимо мыть руки!
Проделанные опыты подтверждают факт существования вокруг нас огромного количества различных микроорганизмов, которые, к сожалению, не всегда бывают «хорошими».
Первоначально разглядывание маленьких живых существ в микроскоп было своего рода забавой для пытливых умов. Прошло немало времени, прежде чем исследование бактерий было поставлено на научную основу. Благодаря этому ученые смогли связать наличие живых микроорганизмов с возникновением болезней и эпидемий.
В наши дни развитие науки вообще и медицины в частности уже невозможно представить без микробиологии. Серьезные научные исследования проводят в лабораториях на специальном оборудовании, но повторить некоторые опыты можно и в домашних условиях.
О существовании бактерий сейчас известно каждому ученику начальной школы, но так было далеко не всегда. Впервые увидеть бактерии смог ученый из Нидерландов Антони ван Левенгук в 1674 г. Чтобы провести исследование и изучение бактерий, ему пришлось самостоятельно разработать и создать первый в истории человечества микроскоп.

Немного позже, в 1828 году, появилось название «бактерия» (от греч. «маленькая палочка»). Слово ввел в обиход немецкий ученый Христиан Эренберг.
Еще позже француз Луи Пастер и немец Роберт Кох, продолжая работу по изучению микроорганизмов, связали возникновение болезней с наличием в организме человека или животного бактерий. За создание бактериологической теории возникновения болезней Роберт Кох в 1905 году был награжден Нобелевской премией.
В XIX веке мир уже понимал, какую опасность таят патогенные бактерии, но организованно бороться с ними люди научились не сразу. Только в 1910 году Рафаэль Эрлих создал первый антибиотик.
Зачем нужны исследования микробов
Исследование живых микроорганизмов необходимо для обнаружения и идентификации возбудителя болезни в организме человека, животного или в окружающей среде. Микробиологическая лаборатория изучает патогенные бактерии, устанавливает их вид и проверяет на устойчивость к антимикробным препаратам.

Микробиологическое исследование необходимо не только для установления точного диагноза (анализы крови, мочи, кала, слизи), но и для определения безопасности для человека окружающей среды. Например, санитарно-эпидемиологическая служба в обязательном порядке исследует продукты, предназначенные для реализации населению.
Отбор проб для исследования
Чтобы получить представление о состоянии человека, животного или окружающей среды, нужны образцы материала (пробы), с которыми и будет работать лаборатория. Для людей и животных это будут различные анализы (кровь, моча, кал) или мазки (слизь), а для исследования продуктов или среды используют небольшое количество самого продукта (мясо, молоко и молочные продукты) или среды.

Пробы для каждого вида исследований берут по определенной методике, но есть несколько общих правил. Нужно использовать стерильную посуду и, по возможности, проводить отбор проб в асептических (обеззараженных) условиях. В лабораторию пробы доставляют как можно быстрее, при необходимости в холодильных боксах. Соблюдение этих условий особенно необходимо в медицине.
Некоторые образцы могут быть опасными для здоровья, поэтому особенно важно правильно оформить сопроводительную документацию.
Методы исследования микроорганизмов
Итак, пробы взяты и доставлены в лабораторию. Думаете, теперь достаточно заглянуть в микроскоп чтобы разобраться что к чему? На самом деле все гораздо сложнее. Есть несколько основных методов определения живых бактерий.
Бактериологическим называют метод исследования бактерий (посев) в различных биологических образцах – материале от заболевшего человека или животного, образцах внешней среды, кормах, мясе, молоке и т.д.
Микроскопия, т.е. изучение под микроскопом лабораторного образца, дает возможность определить общее число микроорганизмов, их форму, размер и строение (их морфологию).

Но нельзя просто сунуть под микроскоп пробирку с молоком или мочой. Чтобы изучить живые (нефиксированные) бактерии, используют препараты, подготовленные одним из двух методов:
- Метод «раздавленной капли». На предметное стекло наносят каплю материала и накрывают покровным. Жидкость должна быть распределена по всей поверхности, но не выступать за границу покровного стекла.
- Метод «висячей капли» используют для живых микроорганизмов при возможности роста колонии. При таком способе можно наблюдать за объектом несколько дней. На покровное стекло капают исследуемый материал, быстро переворачивают каплей вниз и аккуратно укладывают на подготовленное предметное стекло с лункой посередине. Края лунки заранее смазывают вазелином для полной изоляции образца. Затем стекла переворачивают еще раз и получают свободно висящую каплю.
Для исследования патологического (опасного для здоровья) материала используют мазки-отпечатки (из органов, тканей) или тонкие мазки из другого материала. Пробы высушивают, фиксируют (чаще всего пронося образец над горелкой) и окрашивают.
Микроскопия осадка
При некоторых методах исследования изучают не только сам лабораторный материал, но и выпадающий осадок. Этот метод применяют при проведении анализа мочи.
Общий анализ мочи нужен для диагностирования и контроля многих заболеваний. Морфологическое исследование осадка мочи проводят следующим образом: в пробирку наливают 10-12 мл мочи, помещают в центрифугу (скорость 1500-2000 об/мин) на 10-15 мин. Оставшуюся мочу сливают, а осадок перемешивают.

При проведении микроскопии осадка мочи определяют наличие в нем элементов клетки – эритроцитов, лейкоцитов, цилиндров, солей и клеток эпителия.
Выращивание культур микроорганизмов
Культурой бактерий называют совокупность микробов одного вида. Чтобы вырастить культуры бактерий, проводят посев материала на питательную среду. Например, дифтерийную палочку открыли и вырастили в чистой культуре уже 100 лет назад.
Для различных видов бактерий есть определенные комфортные условия (питание, температура, влажность и т.д.), в которых хорошо размножаются основные бактерии, но гораздо хуже посторонние микробы.

Засеянные лабораторные чашки и пробирки отправляют в термостат, где и выдерживают при необходимой температуре один-два дня, а иногда (туберкулез) и до трех-четырех недель. Затем проводят сравнение морфологии с известными признаками бактерий, описанными в классификационных схемах или определителях микробов.
Можно ли вырастить бактерии в домашних условиях
Детям будет любопытно попробовать вырастить собственные колонии бактерий в домашних условиях. Кроме того, такой опыт поможет им на уроках биологии в школе.
Бактерии есть повсюду, на всех поверхностях, в воде, воздухе, почве. Проще всего в домашних условиях использовать микроорганизмы, живущие на кухонных поверхностях или в туалете. Для этого нужна чашка Петри, питательная среда (агар-агар или мясной бульон) и ватный тампон.

Чашку Петри нужно тщательно вымыть, поместить в нее небольшое количество агар-агара или несколько капель мясного бульона. Ватным тампоном протрите любую поверхность на выбор и окуните тампон в питательную среду. Плотно накройте чашку Петри и поставьте в теплое место, где и оставьте ее на 2 – 3 дня. Каждый день наблюдайте за происходящим, можно делать рисунки или фотографии. Покажите детям, что интересные научные опыты можно ставить и в домашних условиях!
Пастеризация молока
Это тоже интересный опыт, который можно провести в домашних условиях, только направленный на уничтожение бактерий.
Французу Луи Пастеру мир обязан появлением молока длительного хранения (пастеризованного). Этот ученый разработал процесс для уничтожения микроорганизмов, находящихся в жидкости. Правда, Пастер обрабатывал вино и пиво, а не молоко.

Пастеризация молока заключается в нагревании его до температуры, близкой к точке кипения, и выдерживания в таких условиях. При пастеризации молока, в отличие от кипячения, не изменяются его вкус, запах и консистенция. Это простой и дешевый способ обеззараживания молока. Кроме того, все кисломолочные продукты теперь тоже изготавливают из предварительно пастеризованного молока.
На обычной кухне можно без труда провести пастеризацию молока. Для этого емкость с молоком ставят на паровую баню (в кастрюлю с горячей водой) и при постоянном помешивании доводят до температуры 63 — 65⁰С. Через полчаса емкость с молоком переносят в холодную воду, чтобы быстрее снизить температуру.
Носители бактерий
Кроме безобидных микроорганизмов, живущих рядом с нами, бывают и затаившиеся враги. Микробы, о которых мы не знаем, как бомба с часовым механизмом, живут в нашем теле и могут «взорваться» в любую минуту.
Болезнетворные бактерии и организм человека какое-то время находятся в равновесии, нарушить которое может усиление или ослабление иммунитета. В первом случае защитная система организма побеждает болезнь, носительство как процесс прекращается. В противном случае ослабление иммунитета приводит к заболеванию.
Виды носительства:
- Здоровое носительство. Болезнетворные бактерии существуют в клетках внешне здорового человека. Как правило, этот процесс длится недолго и сопровождается небольшим количеством патогенных бактерий – чаще всего дифтерийной палочки, возбудителей скарлатины и дизентерии.
- Инкубационное носительство наблюдается при всех инфекционных болезнях, но не всегда означает, что возбудитель выделяется в окружающую среду.
- Острым носительство называют в том случае, когда выделение болезнетворных микробов продолжается от нескольких дней до нескольких недель после того, как человек перенес заболевание. Если процесс длится дольше установленного срока, носительство считается хроническим.
Носительство можно определить только методами лабораторного исследования, выделяя болезнетворные микроорганизмы из мочи, крови, слизи, фекалий. Лечат носителей в стационаре при помощи антибиотиков и вакцинами.
Дифтерийная палочка
Одним из возбудителей, передаваемых носителем, является дифтерийная палочка. Этот микроб имеет множество форм, но хорошо определяется с помощью окрашивания анилиновым красителем.

Дифтерийная палочка
Дифтерийные бактерии растут при свободном доступе кислорода и температуре от 15 до 40⁰С. Хорошо размножаются в среде, содержащей кровь. То есть в организме человека есть все необходимые условия для роста дифтерийных палочек.
Распространяется дифтерийная бактерия также воздушно-капельным путем и представляет большую угрозу для здоровья. При дифтерии возникает острое воспаление верхних дыхательных путей и отравление организма токсинами, выделяемыми дифтерийной палочкой. Это последнее обстоятельство приводит к серьезным поражениям сердечно-сосудистой и нервной системы.
Для проведения бактериоскопии с помощью сухих ватных тампонов берут слизь и пленки из глотки. Анализ должен быть доставлен в лабораторию за три часа или быстрее. Если это невозможно, на месте проводят посев в чашку Петри и уже его отправляют на исследование. Результат появляется через 24 или 48 часов.

Процесс носительства дифтерийной палочки поддерживает циркуляцию заболевания и сохраняет угрозу эпидемии. Основным способом сдерживать рост дифтерийных возбудителей остается активная иммунизация.
Мир бактерий огромен и удивителен. Исследуя микроорганизмы, мы получаем возможность раскрыть многие тайны природы, позаботиться о своем здоровье и сохранить чистоту окружающей среды.
Количество бактерий, живущих в теле среднего здорового взрослого человека превышает число клеток организма в 10 раз. Изменения в этих микробных сообществах могут привести к расстройствам пищеварения, кожным заболеваниям, заболеваниям десен и даже ожирению. Несмотря на жизненно важное значение для здоровья человека и болезни микроорганизмы, проживающие в нас остаются практически неизученными. Только сейчас микробиологи мира, поняв важность бактерий организма, пытаются провести совместные исследовательские усилия, чтобы лучше понять их работу.
Микробы и бактерии в организме
Это, может быть, основой совершенно нового способа посмотреть на болезни. Для того чтобы понять, как влияют бактерии на изменения в нормальной бактериальной популяции необходимо сначала установить какой нормальный уровень должен быть.
Исследователи давно подозревали роль микробного сообщества внутри людей, известный как микробиом человека. Сейчас молекулярные технологии достигли точки, где действительно можно начать выявлять и характеризовать все виды, которые составляют микробиом человека.
Ученые выявили различные микроорганизмы, которые живут на коже человека и помогают сформировать защитный барьер на внешней стороне. Уже известно, что не менее чем 100 различных видов бактерий живут на коже. С помощью относительно новых методов секвенирования ДНК получилось идентифицировать бактериальные виды здоровых испытуемых на предплечье. На других органах человека живут другие бактериальные виды, где количество видов различных бактерий, живущих на коже может подойти к 500. Это вполне возможно, что каждый вид может иметь уникальную бактериальный вид ДНК или уникальный отпечаток.
Первоначальные исследования пациентов с псориазом показывают, например, различия в коже бактериальных популяций пациентов, которые имеют заболевания.
Особенно важна роль бактериальных сообществ в пищеварительном тракте человека при воспалительных заболеваниях кишечника. Изучаются микробные сообщества экосистем, у людей с болезнью Крона, воспалением желудочно-кишечного тракта, язвенным колитом, кишечной палочкой.
Задача микробиологов увидеть в целом в кишечнике изменение микробов и как может это отразиться по отношению к болезни. Рассматривая конкретный организм с воспалительными заболеваниями кишечника видны сдвиги в микробных популяциях между здоровыми и больными людьми, изучая потерю защитных бактериальных популяций.
Бактерии в желудочно-кишечном тракте могут также играть роль в ожирении. Несколько лет назад обнаружено, что ожирение было связано с изменениями и значимым появлением некоторых видов бактерий в пищеварительном тракте. Это говорит о том факте, что их побочные продукты играют потенциальную роль в здоровье и болезнях, что сопоставление и понимание микрофлоры человека имеет важное значение для понимания человеческого здоровья, как и сопоставление и понимание генома человека. В любом случае, с учетом сложности системы, это определенно сложно.
Сейчас используются новые, комплексные лабораторные технологии для описания микробных сообществ, которые не могут быть выращены в лабораторных условиях. Образцы собираются из пяти областей тела, известных заселением микробных сообществ: пищеварительнм тракте, полости рта, коже, носе и женском мочеполовом тракте. Это позволит исследователям соотнести взаимосвязь между изменениями в Микробиом определенного органа к конкретной болезни.
Похожие статьи